Eine aktuelle "BMJ"-Analyse stellt dem Schweinegrippe-Impstoff Pandemrix ein vernichtendes Zeugnis aus.
Im Sommer 2009 hatte die Weltgesundheitsorganisation (WHO) die Schweinegrippe zur weltweiten Seuche erklärt. Die Behörden reagierten und setzten ihre Notfallpläne in Gang. Ziel war es, so rasch wie möglich einen Impfstoff gegen die pandemische Ausbreitung des H1N1-Virus in der Hand zu haben. Bereits damals kritisierten Mediziner und Wissenschafter, dass die Sicherheitsstandards zugunsten einer schnelleren Produktion heruntergesetzt wurden.
Um Millionen Menschen in der Europäischen Union, die sich nach Empfehlungen der zuständigen Behörden gegen die Schweinegrippe impfen lassen wollten, mit der Vakzine versorgen zu können, mischte der britische Pharmakonzern Glaxo Smith Kline (GSK) seinem Impfstoff Pandemrix einen Wirkverstärker bei. Dadurch konnte weniger Wirkstoff auf mehr Menschen verteilt werden.
Doch die Impfung hatte möglicherweise in seltenen Fällen schwere Nebenwirkungen, von denen besonders Kinder betroffen waren. Das legten zumindest die zunehmenden Fälle von Narkolepsie, die etwa in Finnland und Schweden registriert wurden, nahe. Im Gegensatz zu den meisten europäischen Ländern wurde hier auf Massenimpfungen gesetzt. In mehreren Studien wurde schließlich konstatiert, dass der Zusammenhang zwischen Pandemrix und Narkolepsie wahrscheinlich kausal sei. Die schwedische Regierung hat im Mai 2016 beschlossen, Betroffene mit bis zu einer Million Euro zu entschädigen, gegen GSK laufen bis heute Gerichtsprozesse.
Neue Daten aufgetaucht
Nun berichtet das "British Medical Journal" (BMJ), dass relativ rasch klar gewesen sein müsste, dass es beim Herstellungsprozess des europäischen Mittels Probleme gegeben hatte. Peter Doshi, einer der Herausgeber des Fachmagazins, beruft sich dabei auf Daten, die in vier internen Berichten zum Sicherheitsprofil und zu den Nebenwirkungen des Impfstoff zwischen Dezember 2009 und März 2010 bei GSK kursierten. Auszüge daraus wurden jetzt – im Zusammenhang mit Nebenwirkungsklagen – von einem Anwalt offengelegt.
Demnach dürfte bereits zu Beginn der Impfkampagne bekannt gewesen sein, dass der in Europa produzierte und verkaufte Impfstoff Pandemrix deutlich häufiger zu Nebenwirkungen führt als sein kanadischer Ableger, der unter dem Namen Arepanrix auf den Markt gebracht wurde. Zusätzlich wurde in der Analyse ein Schweinegrippe-Impfstoff, der keinen Wirkverstärker enthielt, berücksichtigt.
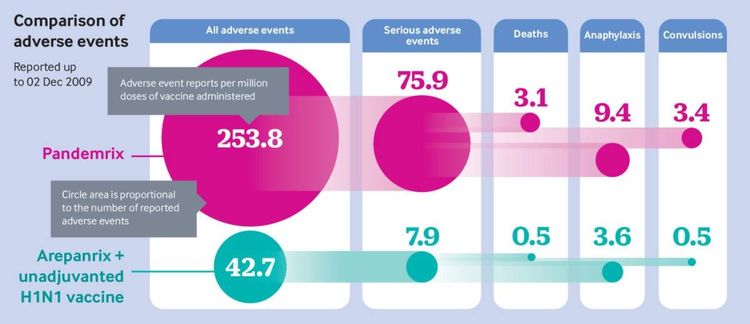
Die Analyse der Daten zeigte, dass bei Pandemrix bis zum 2. Dezember 2009 insgesamt 1.138 schwere Nebenwirkungen dokumentiert wurden, bei dem im kanadischen Quebec produzierten Arepanrix und dem Adjuvans-freien Impfstoff waren es zusammen nur 95. In Relation zur Anzahl der abgegeben Impfdosen wurden für Arepanrix 7,9 schwere Nebenwirkungen pro eine Millionen Geimpfte gemeldet, bei es Pandemrix waren es mit 75,9 um rund das Zehnfache mehr.
Wortkarge Behörden
Bis Mitte Dezember 2009 hatten sich Meldungen über schwere Pandemrix-Nebenwirkungen wie Narkolepsie, allergische Schocks, Gesichtslähmungen, Gefäß- und Gehirnentzündungen auf 3.280 erhöht. Der letzte Bericht vom 31. März 2010 konstatierte 5.069 schwerwiegende unerwünschte Ereignisse bei Pandemrix – etwa siebenmal so viele im Vergleich zu Arepanrix und dem Adjuvans-freien Impfstoff.
In einer Stellungnahme schrieb GSK an "BMJ": "Nach der Einführung von Pandemrix haben wir kontinuierlich alle verfügbaren Sicherheitsdaten ausgewertet und die Daten an die Europäische Arzneimittelbehörde (EMA) geschickt, damit die Behörde ihre eigenen unabhängigen Bewertung vornehmen kann." Die Frage, ob der Pharmakonzern jemals in Erwägung gezogen habe, Pandemrix vom Markt zu nehmen, blieb unbeantwortet.
Vonseiten der EMA heißt es dazu, dass "keine vergleichenden Nutzen- und Risikobewertungen zwischen in der EU zugelassenen Produkten oder zwischen EU-Produkten und Produkten, die außerhalb der EU zugelassen sind, durchführt werden". Eine "BMJ"-Anfrage beim britischen Gesundheitsministerium, warum es Pandemrix statt das Konkurrenzprodukt Celvapan von Baxter empfohlen habe, brachte kein Ergebnis.
Offene Fragen
Mit dem Ende der Schweinegrippe-Pandemie haben Pandemrix und Arepanrix zwar ihre Zulassung verloren, für Peter Doshi bleiben allerdings mehrere Aspekte unbeantwortet: "Die Ereignisse von 2009/10 werfen grundlegende Fragen zur Transparenz von Informationen auf. Wann sind öffentliche Gesundheitsbehörden verpflichtet, die Öffentlichkeit vor möglichen Schäden durch Impfstoffe zu warnen? Wie viele Details sollte die Öffentlichkeit erhalten, wer sollte sie bereitstellen, und sollte die Bereitstellung solcher Informationen proaktiv oder passiv sein?" Antworten darauf hätte wohl nicht nur der Mitherausgeber des "BMJ" verdient. (gueb, 21.9.2018)