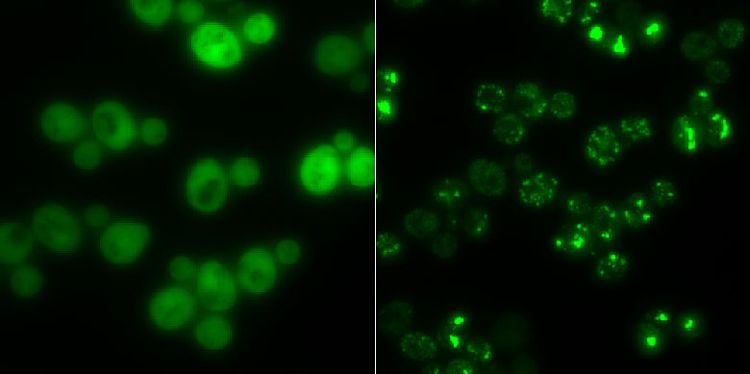
Hefezellen ohne (links) und mit Proteinaggregaten (rechts): In Hungerzeiten dienen solche Klumpen als Zwischenlager für Proteine.
Zürich – Ansammlungen von Proteinen haben keinen guten Ruf: Zahlreiche Krankheiten wie Alzheimer, Parkinson oder Amyotrophe Lateralsklerose (ALS) sind darauf zurückzuführen, dass sich in den Nervenzellen entartete Proteine zusammenlagern. Diese Aggregate können die Zellen nicht auflösen und sie sterben schließlich ab. In einer Untersuchung an Hefezellen rücken Schweizer Forscher nun aber Proteinaggregate in ein neues Licht.
Zwischenlager für Bauteile
Das Team um Matthias Peter und Reinhard Dechant von der Eidgenössischen Technischen Hochschule Zürich (ETH) hat herausgefunden, dass Hefezellen bei Stress wie Nahrungsmangel Protein-Klumpen ausbilden, die ihnen als Zwischenlager für wichtige Bauteile dienen. Nach überstandenem Stress können die Zellen die Aggregate wieder abbauen und die einzelnen Bestandteile rasch rezyklieren und im Zellstoffwechsel einsetzen.
Für die Studie konzentrierten sie sich auf ein Enzym, das eine Rolle im Stoffwechsel der Hefe spielt, Cdc19 genannt. Bei Nahrungsmangel zerfällt dieses Enzym in seine vier identischen Untereinheiten, die wiederum ihre Form verändern und sich mit weiteren Molekülen zu Klumpen zusammenlagern, sogenannten "Stresskörperchen". Cdc19 ist somit inaktiv, die Zelle kann nicht wachsen oder sich teilen, wie die Forscher im Fachblatt "Nature Cell Biology" berichten.
Billiger als neu zu produzieren
Die "Bausteine" dieses Enzyms sind in den Klumpen geschützt vor der zelleigenen Entsorgungsmaschinerie. Ist der Nahrungsmangel vorbei, lösen sich die Stresskörperchen auf, die vier Untereinheiten von Cdc19 lagern sich wieder zusammen und das Enzym kann seine Arbeit wieder aufnehmen. Es nach jeder Stressphase komplett neu zu produzieren, würde die Zelle hingegen viel Zeit und Energie kosten, schrieb die ETH.
"Die Hefezelle benutzt Aggregate als eine Art Lagerstätte für wichtige Enzyme, damit diese in Stresssituationen nicht abgebaut und nach überlebtem Stress sofort reaktiviert werden können", erklärte Peter. "Unsere Forschung hat in der Wissenschaftsgemeinschaft für eine Aufbruchstimmung gesorgt", erläuterte Dechant.
Bisher habe man Aggregate vor allem als krankmachende Partikel betrachtet, weil man in Patienten stets nur das Ergebnis des Vorgangs – unauflösbare Proteinplaques, welche eine Krankheit verursachen – sehe. Die Studie zeige, dass sich die Klumpen nicht ausschließlich aufgrund einer Krankheit bilden, sondern weil die Zelle sie brauche, um Stress zu überleben. (APA, red, 9.10.2017)