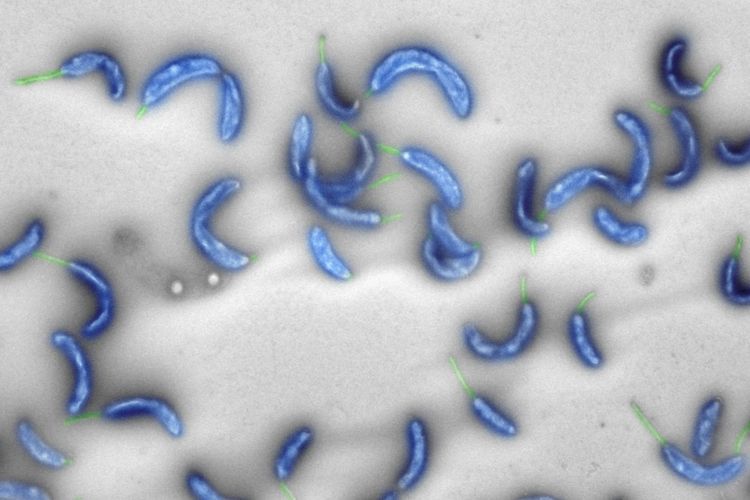
Zürich – 2008 präsentierte Genforschungspionier Craig Venter ein erstes künstlich synthetisiertes Bakteriengenom: Sein Team baute aus chemisch hergestellten Bausteinen das komplette Erbgut des Harnleiterinfektionen auslösenden Bakteriums Mycoplasma genitalium nach. Forscher der ETH Zürich sind nun einen Schritt weiter gegangen und haben ein natürliches Vorbild nicht nur kopiert, sondern stark verändert – und das mit ungleich geringerem Aufwand.
Besagtes Vorbild ist das in vielen Gewässern vorkommende harmlose Bakterium Caulobacter crescentus. Sein Genom umfasst rund 4.000 Gene, von denen aber nur rund 680 überlebenswichtig sind. Dieses sogenannte Minimalgenom haben Forscher um die Brüder Matthias und Beat Christen von der ETH Zürich nun am Computer umgeschrieben, in Teilstücken synthetisiert und nach Funktionstests zusammengebaut. Das Ergebnis, "Caulobacter ethensis -2.0", präsentierten sie im Fachmagazin "PNAS".
Die Methode
Die Schwierigkeit der Herstellung großer DNA-Stücke, wie sie für den Zusammenbau eines künstlichen Bakteriengenoms nötig sind, beschreibt Matthias Christen so: "DNA-Moleküle haben nicht nur die Fähigkeit, sich an andere DNA-Moleküle zu heften, sie können je nach Bausteinabfolge auch Schlaufen und Knäuel mit sich selbst bilden, was die Herstellung erschweren oder verunmöglichen kann."
Deshalb nutzten die ETH-Forscher einen eigens entwickelten Algorithmus, um die Erbgutsequenz des Minimalgenoms umzuschreiben und zu vereinfachen. Der genetische Code enthält nämlich einen gewissen Spielraum: Die DNA-Bausteinabfolge definiert die Abfolge der Aminosäuren. Aber für viele Aminosäuren gibt es mehrere mögliche DNA-Bausteinabfolgen. Der Algorithmus suchte die für die Synthese optimale DNA-Sequenz, ohne dabei die Abfolge der dadurch definierten Aminosäuren zu verändern. Auf Protein-Ebene änderte das Umschreiben des Genoms somit nichts.
Vergleich mit Venter
Anders als beim Projekt von Craig Venter, bei dem die Forscher das Bakterienerbgut eins zu eins nachbauten, entspricht bei "C. ethensis-2.0" mehr als ein Sechstel aller 800.000 DNA-Bausteine nicht mehr dem natürlichen Vorbild.
Ein anderer nicht zu unterschätzender Unterschied ist der Aufwand: An Venters Projekt arbeiteten laut ETH 20 Forscher zehn Jahre lang, die Kosten sollen umgerechnet etwa 35,6 Millionen Euro betragen haben. "C. ethensis-2.0" hingegen kostete eine kleinere Foschergruppe nur rund ein Jahr Zeit und die Herstellungskosten hätten sich nur auf gut 107.000 Euro belaufen.
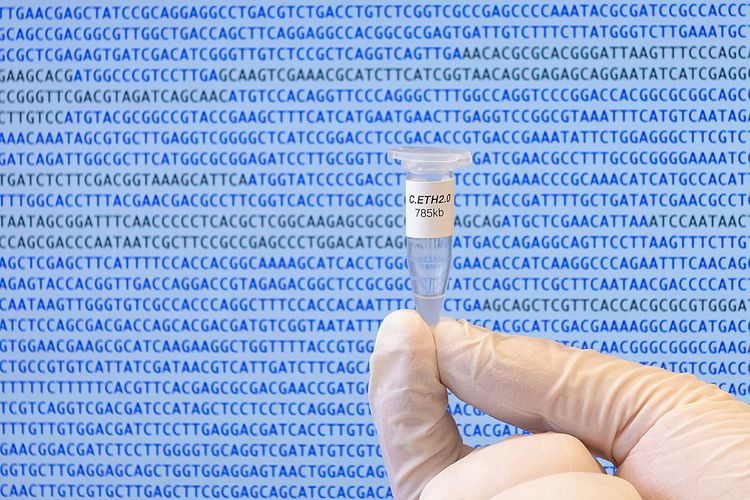
Die neue Methode betrachten die ETH-Forscher auch als "Lackmustest", um zu überprüfen, ob die Biologen die Genetik richtig verstanden hätten, um allfällige Wissenslücken zu entdecken. Denn das umgeschriebene Erbgut enthalte zwangsläufig nur Information, welche die Forscher auch verstanden haben. Allfällige zusätzliche in der DNA-Sequenz "versteckte" und von der Wissenschaft noch nicht verstandene Information wäre durch die Neucodierung verloren gegangen.
Tatsächlich stellten die Forscher fest, dass nur 580 der 680 künstlichen Gene funktionsfähig waren. Mit diesem Wissen wollen sie nun eine voll funktionsfähige Version 3.0 erzeugen. "Auch wenn die derzeitige Genom-Version noch nicht perfekt ist, so zeigt unsere Arbeit dennoch, dass biologische Systeme so einfach aufgebaut sind, dass wir sie in Zukunft am Computer nach unseren Zwecken definieren und anschließend bauen können", sagte ETH-Chemiker Matthias Christen.
Blick in die Zukunft
Bald könnte es möglich sein, aus einem solchen Genom funktionsfähige bakterielle Zellen herzustellen, sind die Forscher überzeugt. Eine mögliche Anwendung solcher synthetischer Mikroorganismen könnten zum Beispiel die Produktion komplexer pharmazeutischer Wirkstoffe oder Vitamine sein.
Bis es solche künstlichen Mikroorganismen gibt, müsse es aber einen intensiven Dialog zwischen Wissenschaft und Gesellschaft geben, betont Systembiologie-Professor Beat Christen: Wichtig sei eine tiefgreifende Diskussion, zu welchen Zwecken diese Technologie angewandt werden dürfe und wie Missbräuche verhindert werden könnten. (APA, red, 1. 4. 2019)