Einer der größten Vorteile von Plastik sollte sich als großer Nachteil herausstellen: Neben den vielfältigen Anwendungsmöglichkeiten ist Plastik nämlich auch extrem beständig. Damit findet man heute nach gerade einmal 100 Jahren Kunststoffproduktion deren Abfälle überall, in den Meeren, im Trinkwasser, in der Nahrung und zunehmend auch in unseren Körpern. Ein zu geringer Anteil des hergestellten Plastiks wird wiederverwendet, und auch das Recycling des Mülls ist problematisch. Es ist teuer, energieaufwendig und liefert schlechtere Produkte oder benötigt selbst frisches Rohöl.
Geschlossener Zyklus der Plastikerzeugung
Einer der industriell wichtigsten Kunststoffe ist PET mit einer Jahresproduktion von 50 Millionen Tonnen. 2016 entdeckten japanische Forscher ein Bakterium, das sich teilweise von PET ernähren kann. Dazu enthält es zwei Enzyme, mit denen es die Polymere verdauen kann: PETase und MHETase. Die PETase spaltet das Plastik in kleinere Bausteine, das sogenannte MHET; dieses wiederum wird von der MHETase in die beiden Grundbestandteile zerlegt, also Terephthalsäure und Ethylenglykol. Diese beiden Stoffen stehen auch am Beginn der PET-Herstellung, womit ein geschlossener Kreislauf aus Aufbau, Abbau und Wiederaufbau möglich wäre.
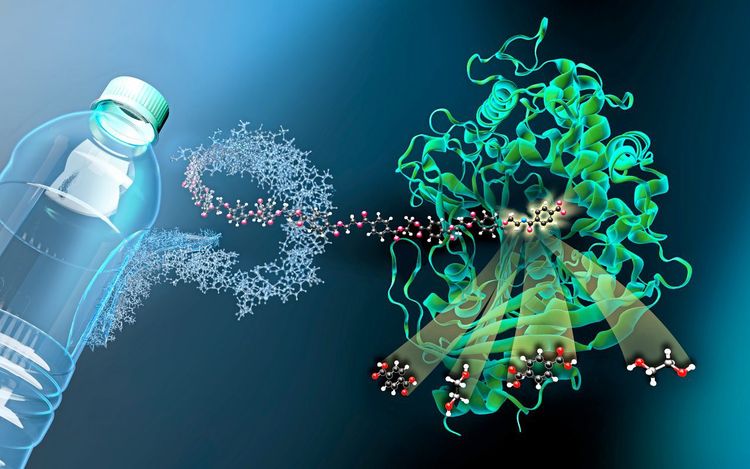
Um diesen Prozess wirtschaftlich durchführen zu können, wird aber noch mehr Information zu den Enzymen benötigt. Ein Enzym ist ein Protein, also ein Eiweißstoff, der chemische Reaktionen beschleunigen kann. Dieser natürliche Katalysator ist aus Aminosäuren zusammengesetzt, deren Reihenfolge und räumlicher Aufbau die Eigenschaften bestimmen. Kennt man beide, kann man sie durch biotechnologische Methoden verändern und aus den neuen Proteinvarianten jene mit den gewünschten Eigenschaften auswählen.
Schnappschuss der Enzymaktivität
Die Struktur des ersten Enzyms, PETase, wurde 2018 aufgeklärt, in der aktuellen Studie auch jene des zweiten, größeren Enzyms, MHETase. Dessen Oberfläche ist doppelt so groß wie die der PETase und bietet damit mehr Potenzial zum verbesserten Abbau von PET. Zur Untersuchung der MHETase bediente man sich eines Tricks: Wenn das normale Ausgangsmolekül der Reaktion leicht verändert wird, kann es zwar vom Enzym noch gebunden, aber nicht mehr gespalten werden. Die Struktur des so blockierten Enzyms wurde dann analysiert. "Durch diese Strukturuntersuchungen können wir der MHETase gewissermaßen 'bei der Arbeit zuschauen‘ und daraus Strategien entwickeln, das Enzym zu optimieren", erklärt Gert Weber vom Helmholtz-Zentrum Berlin.
Jetzt können die Wissenschafter genau lokalisieren, wo das MHET-Molekül an das Enzym bindet und wie es in seine zwei Bestandteile, Ethylenglykol und Terephthalsäure, gespalten wird. Derzeit sind allerdings weder PETase noch MHETase besonders effizient. "Kunststoffe gibt es erst seit wenigen Jahrzehnten in diesem Ausmaß – selbst Bakterien mit ihrer schnellen Generationenfolge und raschen Anpassungsfähigkeit schaffen es nicht in einer so kurzen Zeit, durch den evolutionären Prozess von Versuch und Irrtum eine perfekte Lösung zu entwickeln", erläutert Weber. Im Labor kann dieser Vorgang dagegen gezielt geplant und beschleunigt werden.
So sollen Enzymversionen entwickelt werden, die nicht nur eine höhere Aktivität als natürliche MHETase zeigen, sondern auch ein anderes PET-Abbauprodukt, BHET, nützen können. Am Ende der Entwicklung stünde idealerweise die rohöl-unabhängige Produktion von Plastik: Ein geschlossener Kreislauf, in dem Kunststoff in seine grundlegenden Bausteine zerlegt und aus diesen neu synthetisiert wird. (pkm, 21.4.2019)