Sie könnte der Schlüssel sein, um bislang unheilbare Krankheiten zu kurieren. Sie könnte es aber auch möglich machen, Babys mit maßgeschneiderten Genen im Labor zu zeugen. Kaum eine andere Entwicklung macht deutlicher, dass neue Technologien nie per se gut oder böse sind, wie die Gen-Schere CRISPR/Cas9. Mit jedem weiteren wissenschaftlichen Durchbruch im Bereich der Genom-Editierung stellt sich die Frage: Soll man Gene auf diese Weise verändern dürfen oder nicht?
Wissenschafter allein haben kein Mandat, sie zu beantworten. In Demokratien ist es eine Frage, die sich an die gesamte Gesellschaft richtet. Doch wer weiß schon, was Genom-Editierung überhaupt ist? Und wer kann mit dem Begriff CRISPR/Cas9 etwas anfangen? Laut dem deutschen Bundesinstitut für Risikobewertung nicht allzu viele: "Nur 13 Prozent der über 14-Jährigen haben gemäß unserer Umfrage bislang etwas über Genome-Editing gehört. Es herrscht ein eklatanter Informationsmangel gegenüber einer gesellschaftlich hoch relevanten Technologie", beklagte der Präsident des Bundesinstituts für Risikobewertung, Andreas Hensel, im September des Vorjahrs.
Wenn die Genom-Editierung für Schlagzeilen sorgt, sind es oft negative. Das Bekanntwerden der Geburt der ersten mit CRISPR/ Cas9 veränderten Babys im November 2018 führte international zu Empörung. Doch dazu später. Betrachten wir zunächst einmal, was die Genom-Editierung überhaupt ist, was sie bereits kann und welche Versprechen sie für die Zukunft birgt.
Präzise und billig
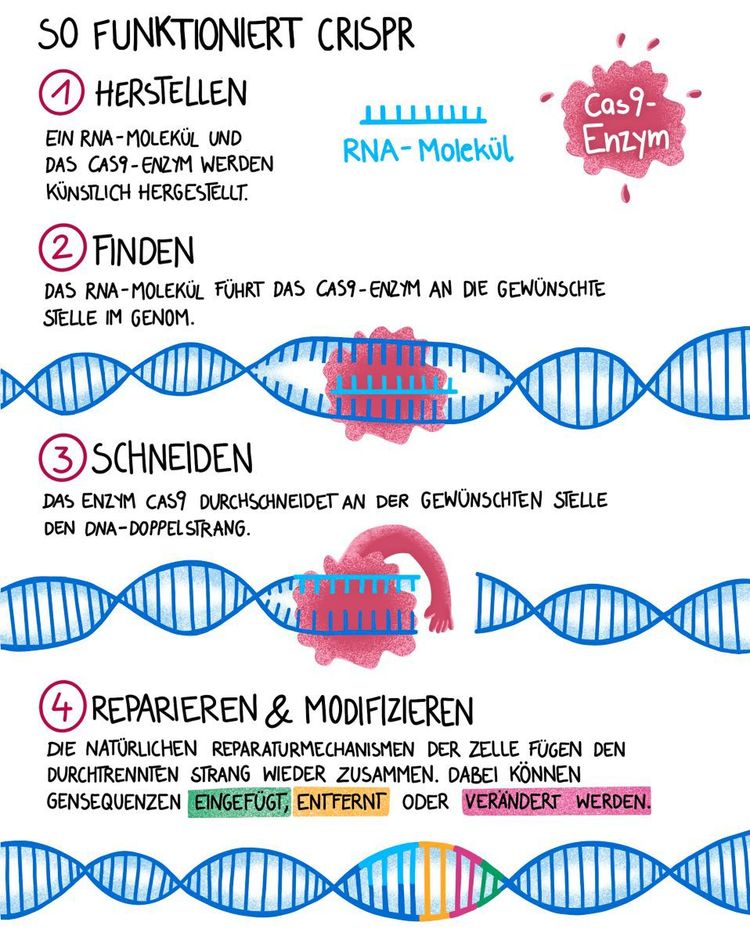
Als die Molekularbiologinnen Emmanuelle Charpentier und Jennifer Doudna 2012 das Werkzeug CRISPR/Cas9 vorstellten, brach ein neues Zeitalter in der Genforschung an. Schon zuvor war es möglich gewesen, einzelne Gene im Erbgut gezielt zu verändern. Doch die Methoden dafür waren äußerst zeitaufwendig, kostspielig und dazu recht unpräzise. Bis zum Auftritt von CRISPR/Cas9. Es handelt sich dabei um einen Mechanismus, mit dem sich einige Bakterien vor Viren schützen: Dank eines gefinkelten Prinzips wird virale DNA, die das Erbgut von Viren trägt, aufgespürt und zerschnitten.
Mit CRISPR/Cas9 kann man aber nicht nur schneiden, es können Gene gezielt aus- oder eingeschaltet oder bestimmte DNA-Sequenzen eingefügt werden. Die Veränderung des Erbguts ist damit rasch, kostengünstig und äußerst präzise möglich. In nur wenigen Jahren wurde CRISPR/Cas9 daher die führende Technologie im Bereich der Genom-Editierung – jenes Wissenschaftszweigs, der sich mit der gezielten Veränderung des Erbguts beschäftigt.
Bereits heute wird sie bei der Züchtung neuer Pflanzen verwendet: In der EU ist zwar noch kein CRISPR-Gemüse zugelassen, aber in einigen anderen Ländern schon. Die Gen-Schere kommt auch in der Tierzucht zum Einsatz, bislang meist zu Forschungszwecken.
Die größten Versprechen birgt die Gen-Schere aber für die Medizin. Noch ist zwar keine CRISPR-Therapie zugelassen, doch es laufen klinische Studien und Tierversuche – und das in sehr unterschiedlichen Bereichen. Dabei geht es um genetische Erkrankungen ebenso wie die großen "Killer" Herzinfarkt und Krebs, bis hin zur Behandlung von Patienten, die es noch gar nicht gibt – Embryonen in der Petrischale.
Vielversprechende Studien
Beginnen wir mit den positiven Nachrichten: Die Ergebnisse der ersten klinischen Studien zu CRISPR-Therapien sind teils sehr vielversprechend. Erst vor wenigen Wochen zeigte etwa eine Therapie mit der Gen-Schere bei einer jungen Patientin aus Deutschland, die an der genetisch bedingten Blutkrankheit Beta-Thalassämie litt, Erfolge. Auch bei der Bluterkrankung Sichelzellenanämie gibt es realistische Heilungschancen durch das neue Werkzeug.
Wie die Therapie von Krebs mittels CRISPR aussehen könnte, beschrieben Forscher Anfang Februar im Fachblatt "Science". Ein Team der University of Pennsylvania und der Stanford University School of Medicine entnahm Krebspatienten Immunzellen. Mittels CRISPR wurden diese genetisch verändert, um schlagkräftiger im Kampf gegen den Krebs zu sein. Anschließend wurden die gedopten Immunzellen wieder in den Körper des Patienten eingeschleust. Im ersten Schritt der klinischen Studie sollte getestet werden, ob die Therapie sicher ist, also keine Schäden anrichtet. Wie die Forscher berichteten, hat diese CRISPR-Therapie den ersten Test bestanden. Nun soll festgestellt werden, ob die Behandlung auch den gewünschten Heilungserfolg erzielt.
Bild nicht mehr verfügbar.
Impfung gegen Herzinfarkt
Eine weitere Therapie basierend auf CRISPR, von der Millionen Menschen profitieren könnten, wird ebenfalls an der University of Pennsylvania entwickelt. Der Kardiologe Kiran Musunuru arbeitet mit seinem Team daran, Cholesterin-Gene mittels CRISPR/Cas9 auszuschalten. "Die Idee ist, die Cholesterinwerte mit einer einzigen Behandlung dauerhaft zu senken, anstatt lebenslänglich Pillen zu schlucken", sagt Musunuru. "Das Ziel wäre so etwas wie eine Impfung gegen Herzinfarkte." Bei Mäusen konnte die Wirksamkeit der Therapie nachgewiesen werden, derzeit laufen Studien mit Affen. "Ich hoffe, dass wir in drei Jahren mit klinischen Studien starten können", sagt Musunuru zum STANDARD.
Der Mediziner war einer der Ersten, der die Gen-Schere in der medizinischen Forschung einsetzte, und attestiert ihr ein großes Potenzial: "CRISPR könnte nicht nur Menschen mit seltenen genetischen Erkrankungen helfen, wir haben damit auch ein Werkzeug gegen die häufigsten Todesursachen der Menschheit." Musunuru ist aber nicht nur begeistert von den Möglichkeiten der Gen-Schere in der Medizin. In gleichem Maße ist er besorgt. Und das hat vor allem mit Zwillingen zu tun, die im November 2018 in China zur Welt kamen und die Hauptprotagonisten seines neuen Buches "The CRISPR Generation" sind.
Manipulation von Embryonen
Zur Vorgeschichte: Im Jahr 2015 führten chinesische Forscher ein Experiment durch, das zuvor noch niemand unternommen hatte: Sie manipulierten menschliche Embryonen mit CRISPR. Diese waren nicht lebensfähig, es war also klar, dass sich daraus nie ein Mensch entwickeln könnte. Dennoch sorgte die Studie für Furore. Zahlreiche Wissenschafter setzten sich dafür ein, die Genom-Editierung bei Embryonen zu verbieten. Im Dezember 2015 verabschiedeten die wichtigsten Wissenschaftsakademien – darunter die chinesische und US-amerikanische – eine Übereinkunft, wonach die Genom-Editierung von Embryonen zu unterlassen sei, solange diese nicht sicher ist und es keinen gesellschaftlichen Konsens über solche Versuche gibt.
Dieser freiwillige Forschungsstopp wurde 2017 infrage gestellt, als US-Wissenschaftsakademien in einer Stellungnahme die Ansicht vertraten, dass die Genom-Editierung von Embryonen für manche Paare die zukünftig einmal vertretbarste Option sein könnte, ein gesundes Kind zu zeugen. "Das war ein rhetorischer Dammbruch", sagt Robert Ranisch, Ethiker an der Uni Tübingen. "Zum ersten Mal erklärte eine große Wissenschaftsakademie, dass Keimbahneingriffe, die lange als rote Linie galten, zulässig sein könnten."
Die ersten CRISPR-Babys
Bei einem internationalen Kongress zur Genom-Editierung in Hongkong im November 2018 sollte das Memorandum von 2015 dennoch erneut bekräftigt werden. Doch dem weitgehenden Konsens der Forschergemeinde, wonach kein mit CRISPR bearbeitetes Kind gezeugt werden sollte, machte eine Woche vor dem Kongress ein Youtube-Video einen Strich durch die Rechnung. Darin gab der chinesische Biophysiker He Jiankui die Geburt der Zwillinge Lulu und Nana bekannt, deren Erbgut er mittels CRISPR/Cas9 verändert hatte.
Bei seinem Vortrag auf dem Hongkonger Kongress betonte He, dass hinter seiner Arbeit die besten Absichten stünden: Der Vater der Zwillinge sei HIV-positiv. Indem He dessen Kindern im Embryonalstadium eine Gen-Mutation verpflanze, die sie resistent gegenüber einer HIV-Infektion mache, ermögliche er dem Paar die Geburt gesunder Kinder. Als wenig später noch ein drittes CRISPR-Baby aus Hes Labor geboren wurde, war der Forscher bereits von der Bildfläche verschwunden. Nicht nur Experten und die Weltöffentlichkeit zeigten sich von den Experimenten entsetzt, auch die chinesischen Behörden. Vergangenen Dezember wurde He schließlich zu einer dreijährigen Haftstrafe, einer Geldstrafe und lebenslangem Berufsverbot wegen "illegaler medizinischer Praktiken" verurteilt.
Ethisches Fiasko
Kiran Musunuru hatte schon vor Bekanntwerden des Skandals von den Zwillingen erfahren. Eine Reporterin hatte ihm Hes Manuskript zugespielt, um seine wissenschaftliche Einschätzung einzuholen. "Als ich mir die Daten ansah, erkannte ich sofort, dass sie echt sein mussten und keine Fälschung sind", berichtet Musunuru. Denn für eine Fälschung schienen die Daten zu schlecht und unsauber.
"Ich war entsetzt, schockiert und überrascht zugleich", sagt Musunuru, "nicht nur, weil He die rote Linie überschritten hatte, sondern auch, weil er so unverantwortlich dabei vorgegangen ist. Er wusste nicht, was er tat, und er hat es vermasselt." Die Daten von Hes – bis heute unveröffentlichtem – Manuskript zeigen laut Musunuru, dass die Babys einen genetischen Schaden durch den Einsatz von CRISPR/Cas9 erlitten haben. Ob sich das negativ auf die Gesundheit der Zwillinge auswirken wird, ist noch unklar. "Wenn man Hes Manuskript gelesen hat, sieht man, dass er in seiner Wahrnehmung etwas Gutes tat", sagt Musunuru. "Doch von außen betrachtet war es keine historische wissenschaftliche Errungenschaft, sondern ein ethisches Fiasko."
Bild nicht mehr verfügbar.
Augenfarbe nach Bestellung
Ob es eines Tages weitere mit Genome-Editing veränderte Babys geben wird, ist eine Frage, die für Musunuru nicht pauschal entschieden werden kann. "Bei diesem Thema gibt es viele Grauschattierungen." Ein zukünftiger gesellschaftlicher Konsens sei denkbar, wenn es um Paare geht, die nur mittels Genome-Editing ein gesundes Kind bekommen könnten. Im Fall von Hes Eingriff hätte es auch andere Möglichkeiten gegeben. Ein anderes Szenario wäre, die Gene von Embryonen so zu verändern, dass damit das Risiko sinkt, später an Alzheimer oder Krebs zu erkranken.
Auf einem ganz anderen Blatt steht genetisches Enhancement. Noch sei die Wissenschaft nicht so weit, aber es könnte eines Tages möglich werden, die Augenfarbe eines Kindes oder gar Intelligenz und athletische Fähigkeiten zu beeinflussen, so Musunuru. "Aktuell befürwortet kaum jemand so ein Szenario." Doch selbst wenn sich die internationale Gemeinschaft Keimbahninterventionen verbietet, heißt das nicht, dass es solche Angebote nicht trotzdem geben könnte. "Wenn es Menschen gibt, die bereit sind, dafür zu zahlen, werden sich Leute finden, die das anbieten."
Für den Mediziner ist CRISPR/Cas9 wie ein Spiel mit dem Feuer: Geht man sorgsam damit um, kann es von größtem Nutzen für die Menschheit sein. Bei Unvorsichtigkeit droht Kontrollverlust – mit fatalen Folgen. (Tanja Traxler, David Rennert, 19.2.2020)