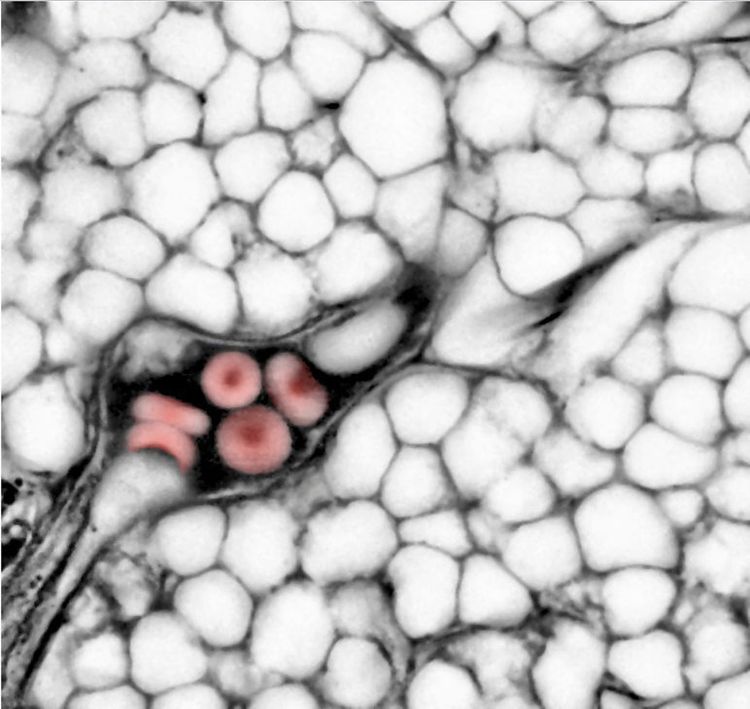
Blick in einen lebendigen Lymphknoten mit einem Lichtmikroskop. Zu erkennen ist die Kontur diverser Immunzellen, die miteinander interagieren, und ein Blutgefäß mit roten Blutkörperchen.
Wie blickt man am besten in eine lebende Zelle, um die Vorgänge des Lebens zu beobachten? Die Elektronenmikroskopie, die mit einem Teilchenstrahl Proben – im Vakuum – "abrastert" und dabei besonders gute Auflösungen erzielt, ist hier nicht einsetzbar. Hier ist die gute alte Lichtmikroskopie gefragt, die biologische Proben ohne verzerrende Beeinflussung untersuchbar macht.
Die Nutzung von Licht ist durch seine wellenförmige Ausbreitung allerdings anderen Limitierungen unterworfen. Die maximalen mit den klassischen Methoden erreichbaren Auflösungen sind auf etwa 200 Nanometer begrenzt. Man kann also vielleicht Zellkern, Mitochondrien und andere größere Strukturen in der Zelle noch erkennen, Details bleiben aber verborgen.
Verborgene Informationen
Mittlerweile haben sich Wissenschafter aber einige "Tricks" überlegt, wie sie die Barriere der Lichtbeugung doch noch durchbrechen können. Der Physiker und Mediziner Johann Danzl, der eine Arbeitsgruppe zu nicht-beugungslimitierten Mikroskopieformen am Institute of Science and Technology (IST) Austria in Klosterneuburg leitet, entwickelt hier etwa den Ansatz der STED-Mikroskopie (Stimulated Emission Depletion) weiter – eine Methode, die gezielt Moleküle mithilfe von Fluoreszenz sichtbar macht.
"Wir stellen uns immer aufs Neue die Frage, wie wir bisher verborgene Informationen aus biologischen Proben gewinnen können. Dabei decken wir alle notwendigen Bereiche ab – von biologischen Fragestellungen über die physikalischen Prinzipien der Bildentstehung bis zu den Auswertungsalgorithmen", betont Danzl, der vor dem Engagement am IST Austria Postdoc-Fellow bei Stefan Hell am Max-Planck-Institut für biophysikalische Chemie in Göttingen war. Hell wurde für die Erfindung der STED-Mikroskopie 2014 mit dem Chemienobelpreis ausgezeichnet.
Gebündelte Lichtquellen
Doch wie funktioniert eine derartige Methode im Detail? Versucht man eine Probe mit gebündelten Lichtwellen abzutasten, lässt sich das Lichtwellen-"Bündel" ab einem gewissen Bereich nicht mehr stärker auf einen Punkt konzentrieren. Es bleibt ein "Fleck", innerhalb dessen sich keine Informationen gewinnen lassen, veranschaulicht Danzl.
Auf diese Weise hat man keine Chance, feinere Details zu erfassen. Man kann etwa Synapsen, die Signale zwischen Gehirnzellen übertragen, identifizieren, aber nicht, wo an ihnen Neurotransmitter freigesetzt werden.
Fluoreszenz
In der STED-Mikroskopie ist das anders. Hier werden die zu beobachtenden Bereiche mit fluoreszierenden Farbstoffmolekülen versehen. Mithilfe von Licht einer bestimmten Wellenlänge können diese Moleküle angeregt werden, sodass sie – leicht verzögert – ein Lichtteilchen abgeben, das sehr genau nachgewiesen werden kann.
Gleichzeitig schafft man aber auch eine enge räumliche Eingrenzung, die festlegt, wo diese Anregung vor sich gehen darf. Alle anderen markierten Strukturen werden mit einem zusätzlichen, ringförmigen Lichtstrahl, der den anregenden Strahl umschließt, "abgeregt" – hier werden die Lichtemissionen also unterdrückt.
Mit diesem Ansatz schafft man es weit unter das Limit, das die Lichtbeugung sonst vorschreibt. Man kommt den molekularen Zusammenhängen in der Zelle näher, kann Molekülcluster erkennen oder Lagebeziehungen verschiedener Molekülarten in der Zelle erfassen. Dazu werden sogenannte Mehrfarbenmessungen durchgeführt: Verschiedene Molekültypen werden dabei individuell markiert, jeweils angeregt, vermessen und zu 3D-Aufnahmen zusammengefügt, die Auskunft über die jeweilige Position der Moleküle zueinander geben.
Dies ist mittlerweile sogar in biologischen Geweben möglich. Die Mikroskopie erschließt hier die Größenskalen vom Gewebekontext über die einzelnen Zellen bis hin zur molekularen Architektur.
"Identität" der Zelle
Eine besondere Anwendung der Sichtbarmachung vieler verschiedener Moleküle im Lichtmikroskop: Man kann sozusagen die Genexpression beobachten und aufgrund umfangreicher Moleküldaten von RNA oder vorhandener Proteine erkennen, welches genetische Programm aktiviert und zu welcher Funktion die Zelle also ausersehen ist. Man kann so die "Identität" der Zelle feststellen.
Gleichzeitig muss man in diesem Fall gar nicht die höchsten Auflösungen ausreizen, um sinnvolle Anwendungen zu finden. In einem Projekt, das die Danzl-Gruppe, gefördert von der NÖ Forschungs- und Bildungsgesellschaft (NFB), mit der Karl-Landsteiner-Privatuniversität für Gesundheitswissenschaften, dem Universitätsklinikum St. Pölten und in Kooperation mit der Stanford University durchführt, wird die Methode etwa genutzt, um das Zusammenspiel von Zellen bei allergischen Krankheiten zu untersuchen.
Die Forscher sehen sich dabei an, wie verschiedene Zelltypen, etwa in gesundem und krankem Lymphgewebe, angeordnet sind, um Auffälligkeiten zu finden, die mit Allergien assoziierbar sind. In einem weiteren Schritt könnten molekulare Marker gefunden werden, die in Zusammenhang mit den Krankheiten stehen, Danzl: "Die Langzeitvision ist, mit solchen Biomarkern einen Beitrag zu einer individualisierten Medizin leisten zu können."(Alois Pumhösel, 30.6.2020)