
Eigennützige Gene – auf Englisch "selfish genes" – sind in der Biologie seit Jahrzehnten ein Thema. Sie sind wie Parasiten vor allem auf das Nutznießen und die eigene Reproduktion eingestellt und bringen ihrem Wirt oft keinerlei Vorteile.
Seit 2019 leitet der Wissenschafter Alejandro Burga in Wien eine Forschungsgruppe zu einer extremen Unterkategorie dieser DNA: den sogenannten Toxin-Antidot-Elementen. Hierbei handelt es sich um zwei Gene, die sozusagen für die Anfertigung eines Gifts und seines Gegengifts sorgen. Nur jene Individuen, die die beiden Teile vererbt bekommen, überleben. Die Gene machen sich selbst also lebensnotwendig und verbreiten sich deshalb immer weiter.
Burga hat erst in den vergangenen Jahren zu seinem aktuellen Steckenpferd gefunden. Die großen Fragen der Biologie haben den 35-Jährigen schon früh beschäftigt, und als 2003 das menschliche Genom entschlüsselt wurde, stand seine Laufbahn für ihn fest. Aufgewachsen in der peruanischen Hauptstadt Lima, war für den jungen Alejandro Raúl Burga Ramos jedoch eines klar: "Ich wusste, dass ich früher oder später einen Weg außerhalb von Peru finden muss, um Wissenschaft zu betreiben."
Heute mag die Situation etwas besser sein, aber in seiner Jugend befürchtete er, als Forscher nicht für seinen Lebensunterhalt sorgen zu können. Die staatlichen Forschungsförderungen sind niedrig, das Bildungssystem gilt als veraltet. Für sein Biochemiestudium zog er nach Santiago de Chile, für das Doktorat nach Barcelona.
Vom Kormoran zum Fadenwurm
Während des Postdocs an der Universität Kalifornien, Los Angeles (UCLA), erforschte Burga, welche Gene für die Evolution des Galapagoskormorans essenziell waren. Dieser Vogel kann im Gegensatz zu allen anderen Mitgliedern der Kormoranfamilie nicht fliegen. Für seine kleinen Flügel sind die gleichen Gene verantwortlich, die in anderen Tieren – Mensch inklusive – für Fehlbildungen der Extremitäten sorgen.
Vor zwei Jahren nahm Burga eine Stelle als Gruppenleiter am Wiener Institut für Molekulare Biotechnologie (IMBA) der ÖAW an. Finanziert durch den renommierten Starting Grant des Europäischen Forschungsrats (ERC), arbeitet der Molekularbiologe am IMBA mit eigennützigen Genen. Der Modellorganismus seiner Wahl ist meist der Wurm C. elegans, in dem Burga bereits Toxin-Antidot-Elemente nachweisen konnte.
Kampf um Dominanz
Ein Beispiel für ihre Wirkungsweise: Ein männlicher Wurm hat ein Toxin-Antidot-Paar in der eigenen DNA. Dadurch produziert er giftige Proteine und gibt diese all seinen Spermienzellen mit. Selbst ist er durch das Gegengift geschützt. Aber wenn seine Nachkommen die Toxin-Antidot-Gene nicht erben, können sie kein Gegengift produzieren und sind nicht lebensfähig. Das kann immerhin 25 Prozent der Nachkommen betreffen.
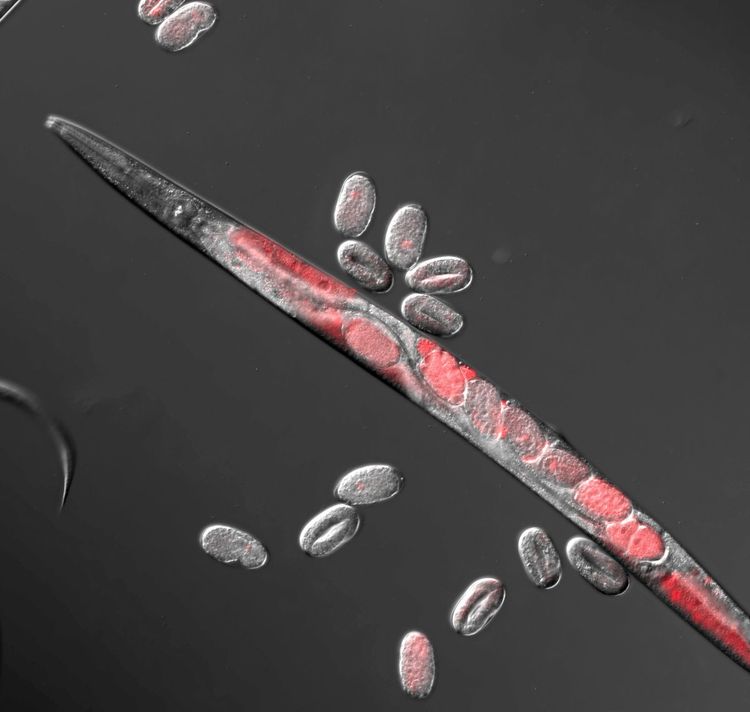
Egoistische Gene kämpfen für ihr eigenes Überleben – und um die Dominanz in einer Population. Um das bestmöglich umzusetzen, entwickeln sie neue Funktionen, wie in diesem Fall Gift und Gegengift. Deshalb sagt Burga: "Die Konflikte zwischen diesen eigennützigen Elementen in der DNA können eine Quelle der Innovation sein. Das lässt sich mit dem Wettstreit in Sachen Raumfahrt zwischen den USA und der Sowjetunion vergleichen. Während des Kalten Kriegs kämpften die Großmächte nicht etwa um den ersten Platz im All und auf dem Mond, weil die Vorstellung davon so schön war. Es ging darum, Kontrolle über diesen Bereich auszuüben – ein Kampf um Dominanz. Ein Nebenprodukt dieses Wettrennens war, dass die Raumfahrttechnologie entwickelt wurde. Jetzt profitieren wir alle davon, dass es Satelliten gibt."
Biologische Barrieren
Burga und seine Kollegen vermuten, dass egoistische Elemente auch die Entstehung neuer Arten beeinflussen könnten. Damit sich eine Art von einer anderen abgrenzt, müssen biologische Barrieren entstehen – etwa ein Fortpflanzungsapparat, der nicht mehr mit bestimmten Individuen kompatibel ist.
"Nach aktuellem Wissensstand gibt es nur eine Handvoll Gene, die bei der Bildung solcher Hindernisse eine Rolle spielen. Daher würde es mich nicht überraschen, wenn auch egoistische Elemente dazu beitragen würden." Die Entstehung einer neuen Art könnte dabei eine ungeplante Konsequenz der eigennützigen DNA sein: "Artenbildung als Nebenprodukt eines Konflikts zwischen Genen, die überleben wollen – ich finde diesen Gedanken faszinierend."
Toxin-Antidot-Paare sind noch wenig erforscht. Burga war etwa Mitentdecker eines Gegengift-Gens, das bisher für ein ganz anderes Gen gehalten wurde. Auch andere DNA-Abschnitte, die bisher für die richtige Entwicklung von Organen verantwortlich gemacht wurden, könnten versteckte Gegengift-Gene sein. Das bedeutet, dass egoistische Elemente vielleicht häufiger sind als gedacht.
Und: Zwei verschiedene Egoisten können auch miteinander in Konflikt geraten. Wenn ein Großteil des Nachwuchses stirbt, weil entweder das eine oder das andere Gegengift fehlen kann, kann das für die Trennung der Spezies sorgen. "In diesem Fall wäre es für zwei Populationen mit verschiedenen egoistischen Elementen besser, wenn sie sich nicht vermischen", sagt Burga. So könnte sich eine neue Art herausbilden.
Von Medea zu Medaka
Um die gewitzten Gene besser zu verstehen, untersucht der Forscher zusammen mit Strukturbiologen die Genprodukte – also die giftigen Proteine und ihre Gegenspieler. Dadurch wollen sie lernen, wie der Wirkmechanismus funktioniert.
In den nächsten Forschungsschritten will er anhand der Fisch-Spezies Medaka (Japanischer Reisfisch) herausfinden, ob diese eigennützige DNA auch in Wirbeltieren vorkommt. Bisher wurde sie etwa in Mehlkäfern nachgewiesen und dort als Medea-Element bezeichnet: Weil die Weitergabe des Gifts hier durch die mütterlichen Eizellen stattfindet, heißt das Gen wie die Figur in der griechischen Mythologie, die ihre Kinder tötete.
Aber auch Pflanzen, Pilze und Bakterien besitzen solche Gene. Daher fragt Burga: "Warum sollten sie gerade bei Wirbeltieren nicht auftreten? Und falls sie hier nicht auftreten: Was macht uns so besonders?" (Julia Sica, 8.2.2021)