Ein zentraler Aspekt der modernen wissenschaftlichen Forschung und ein treibender Faktor für den wissenschaftlichen Fortschritt ist die Entwicklung neuer Methoden. Insbesondere im Bereich der Hirnforschung ermöglichen diese Methoden nicht nur immer präzisere und detailliertere Einblicke in die Strukturen des Gehirns, sondern auch ein tieferes Verständnis komplexer Zusammenhänge.
Vor über 100 Jahren wurde der erste Nobelpreis im Bereich der neurobiologischen Forschung an Camillo Golgi und Santiago Ramón y Cajal (1906) für ihre bahnbrechende Arbeit zur Struktur von Nervenzellen verliehen. Diese Arbeit legte einen wichtigen Grundstein für unser heutiges Verständnis des Gehirns. Dank des technologischen Fortschritts des letzten Jahrhunderts können wir heutzutage nicht nur die Strukturen von Nervenzellen im fixierten Gewebe betrachten, sondern sogar die Aktivität in solchen Strukturen im intakten Gehirn von Modellorganismen beobachten. Dies erlaubt es, Zusammenhänge zwischen der Aktivität von Nervenzellgruppen und zum Beispiel der kognitiven Leistung oder der Verhaltensänderung von Modellorganismen zu erkennen.
Dynamische Vorgänge von Molekülen verfolgen
Auch meine Arbeitsgruppe an der Medizinischen Universität Wien nutzt solche Technologien, um Zellen im Gehirn zu beobachten und die Auswirkungen einzelner Moleküle auf die Aktivität von Zellen im Verhaltenskontext zu untersuchen. Eine ähnliche Technologie, die momentan weltweit in mehreren Forschungsgruppen einschließlich meiner Gruppe entwickelt wird, zielt darauf ab, nicht nur einzelne Zellen und ihre Aktivität zu beobachten, sondern sogar einzelne Moleküle im intakten Gehirn sichtbar zu machen. Während bisher vor allem hochauflösende Mikroskope zur Visualisierung von Molekülen in fixiertem Gewebe eingesetzt wurden, zielen die neuesten Methoden darauf ab, Moleküle mithilfe innovativer bildgebender Verfahren im Kontext kognitiver, emotionaler und physischer Prozesse in lebenden Modellorganismen zu beobachten. Dies ermöglicht es, die dynamischen Vorgänge von Molekülen im Gehirn zu verfolgen und eine Brücke zwischen der molekularen Ebene und dem Verhalten von Modellorganismen zu schlagen.
Ein weiterer bedeutender Nobelpreis in der neurobiologischen Forschung wurde an Jennifer Doudna und Emmanuelle Charpentier für die Entdeckung der CRISPR-Cas9-Technologie verliehen (2020). Diese Technologie ermöglicht das präzise Herausschneiden und Manipulieren einzelner Gene. Sie kommt heutzutage vereinzelt sowohl in der Klinik als auch vielfach in der Grundlagenforschung zum Einsatz. Zahlreiche genetische Studien konnten Veränderungen im menschlichen Genom mit einem erhöhten Risiko für bestimmte Krankheiten in Verbindung bringen. Wie es jedoch von kleinen Genomveränderungen im Gehirn zu solchen Risikoerhöhungen kommt, ist häufig noch unklar. Die neue Entwicklung der CRISPR-Cas9-Technologie kann hier neue Aufschlüsse bieten. Daher widmet sich auch meine Gruppe mithilfe europäischer Fördermittel (European Research Council, ERC) der Aufklärung der Funktion von Genen, die mit einem erhöhten Risiko für neuropsychologische Störungen in Verbindung gebracht werden. Hierzu entwickelt die Gruppe mithilfe der CRISPR-Cas9-Technologie präzise genetische Werkzeuge, um einzelne Gene gezielt auszuschalten. Auf diese Weise können einzelne Molekülklassen im Gehirn auf ihre Funktion in emotionalen, kognitiven und physischen Prozessen in Modellorganismen untersucht werden.
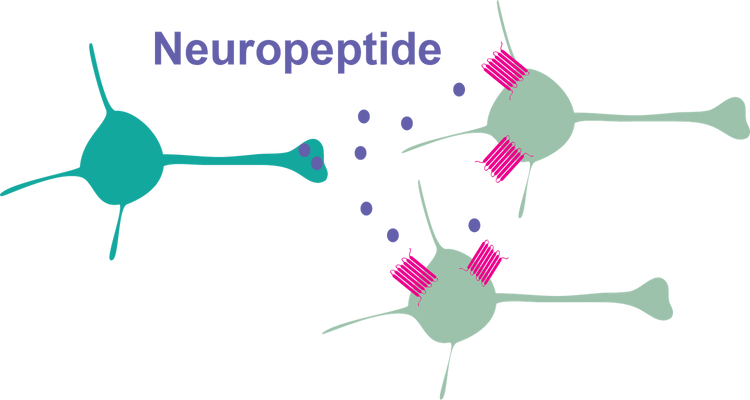
Neuropeptide
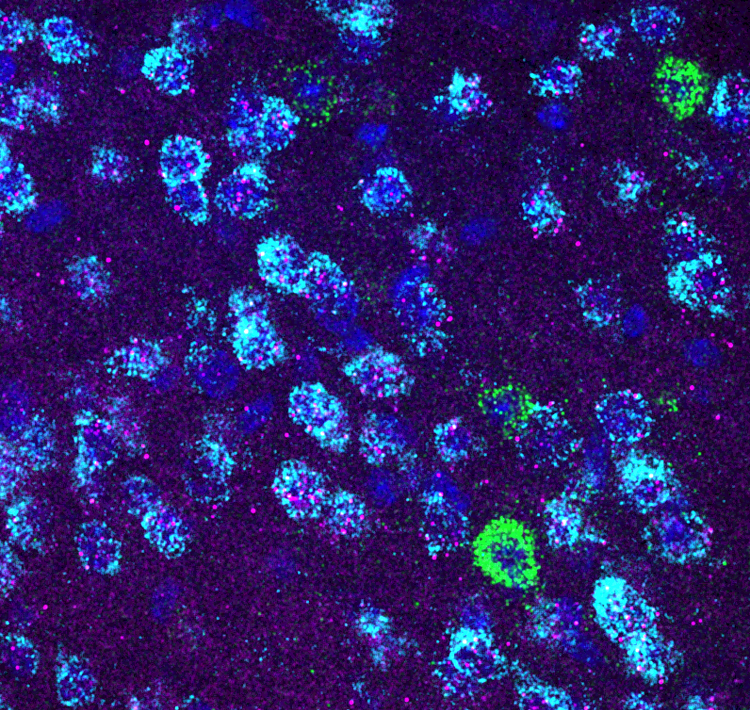
Neuropeptide sind Signalmoleküle, die von Nervenzellen freigesetzt werden und sich an spezifische Andockstellen (Rezeptoren) auf bestimmten Zellgruppen binden können, um deren Aktivität, Stoffwechsel oder Funktion zu beeinflussen. Obwohl das Gehirn viele verschiedene Klassen solcher Signalmoleküle enthält, bilden Neuropeptide die größte Klasse und umfassen etwa 100 verschiedene Typen, die von etwa 100 verschiedenen Genen codiert werden. Die neueste Forschung meiner Gruppe untersucht Interaktionen und Wirkungen dieser Neuropeptide in Gehirnregionen, in denen ihre Rolle noch nicht vollständig bekannt ist. Die CRISPR-Cas9-Technologie ermöglicht es, gezielt bestimmte Typen dieser Neuropeptide oder Teile ihrer Signalwege auszuschalten, um ihre Wirkungsweise und Funktion in kognitiven und neuropsychologischen Prozessen in Modellorganismen zu untersuchen. Das Forschungsprojekt wird vom Wiener Wissenschafts-, Forschungs- und Technologiefonds (WWTF) unterstützt, der es ermöglichte, die Forschungsgruppe in Wien zu etablieren. Von besonderem Interesse für die Gruppe sind Neuropeptide und Signalwege, bei denen genetische Veränderungen nicht nur zu verändertem Verhalten bei Modellorganismen führen, sondern auch das Risiko für neuropsychische und neurodegenerative Probleme beim Menschen erhöhen.
Das Verständnis der komplexen Wechselwirkungen zwischen Neuropeptiden, zellulären Prozessen auf Netzwerkebene und Verhalten sowie Emotionen ist das Hauptziel der Forschungsgruppe. Durch den Einsatz neuer Technologien strebt die Forschungsgruppe an, einzelne Bausteine der Nervenzellen im Kontext von Verhaltenstests zu untersuchen, um damit einen wesentlichen Beitrag zum molekularen Verständnis von neuropsychologischen und kognitiven Störungen zu leisten. (Sarah Melzer, 3.4.2024)